Wstęp do reakcji pericyklicznych – Diels-Alder
Mając kontakt z chemią olimpijską, a przynajmniej licealną, z pewnością mieliście kontakt z reakcjami, zachodzącymi zgodnie z jednym z dwóch mechanizmów – reakcje polarne, w którym nukleofil „atakuje” elektrofil, przy pomocy swoich par elektronowych oraz rodnikowe, w których pojawiają się cząsteczki posiadające niesparowane elektrony.
W tym artykule zostanie omówiona jedna z reakcji perycyklicznych, w których cząsteczki przyjmują cykliczny stan przejściowy. Do zrozumienia tych przekształceń przydaje się, przynajmniej podstawowa, znajomość orbitali cząsteczkowych i ich poziomów energetycznych.
Orbitale cząsteczkowe – przypomnienie
Orbitale są funkcjami falowymi, przez co mogą ulegać interferencji (nałożyć się). W wyniku nakładania się na siebie orbitali atomowych powstają orbitale cząsteczkowe, których energia zależy od sposoby typu interferencji.
– interferencja konstruktywna- orbitale nakładają się w tej samej fazie (funkcje falowe mają ten sam znak, np. + i +) → powstaje orbital wiążący o niższej energii niż wyjściowe orbitale atomowe,
– interferencja destruktywna – orbitale nakładają się w przeciwfazie (funkcje falowe mają przeciwne znaki) → powstaje orbital antywiążący, posiadający płaszczyznę węzłową i wyższą energię niż wyjściowe orbitale atomowe.
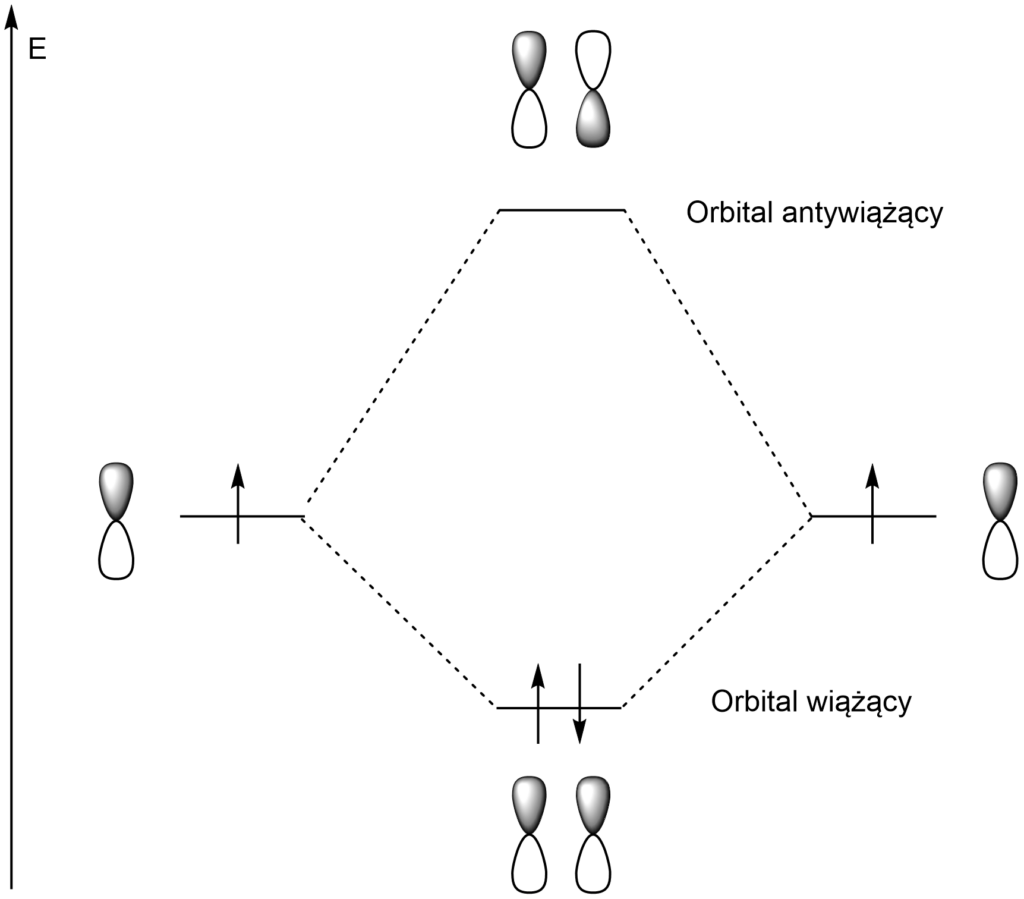
Jak widać na schemacie, przez nałożenie się dwóch izolowanych orbitali p, powstają dwa orbitale π.
Podobna sytuacja występuje, gdy nakłada się więcej orbitali p. Następuje to w cząsteczkach ze sprzężonymi wiązaniami wielokrotnymi, np. w buta-1,3-dienie.
Wówczas poziomy energetyczne rozkładają się w ten sposób:
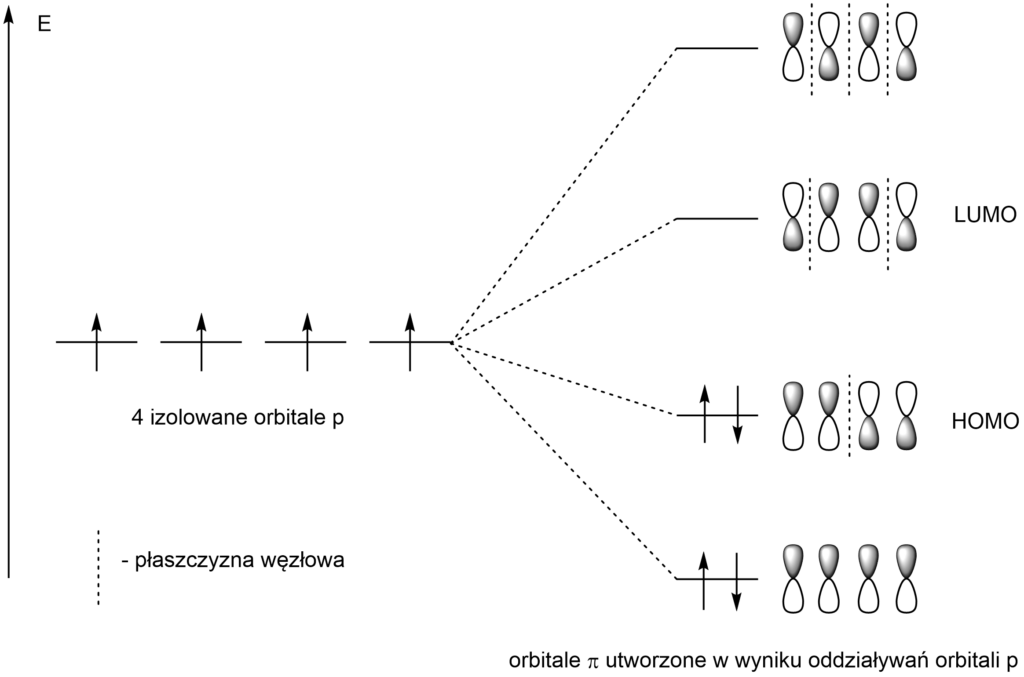
HOMO – najwyższy energetycznie orbital, obsadzony elektronami
LUMO – najniższy energetycznie orbital, nieobsadzony elektronami
Łatwo zauważyć, że liczba płaszczyzn węzłowych bezpośrednio przekłada się na energię orbitalu.
Najbardziej znana cykloaddycja – reakcja Dielsa-Aldera
Jest to reakcja między dienem i dienofilem, najczęściej alkenem. W jej teoretycznie najprostszym wariancie wygląda ona w ten sposób:

No dobra, znamy już produkt reakcji, ale jak on właściwie powstaje?
Jak wcześniej wspomniałem, reakcje perycykliczne zachodzą przez cykliczny stan przejściowy.
Dla tych dwóch substratów wygląda on w ten sposób:
Sam mechanizm, dla uproszczenia, można także zapisać przy użyciu zakrzywionych strzałek:
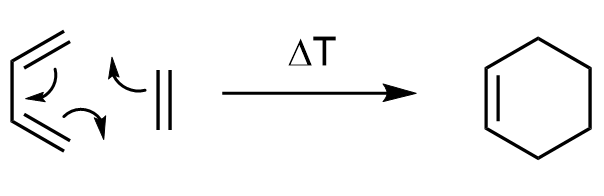
Podsumowując, w reakcji tworzą się dwa nowe wiązania σ i jedno wiązanie π.
Orbitale cząsteczkowe w reakcji Dielsa-Aldera
Reakcja Dielsa-Aldera, w większości przypadków, zachodzi przez nałożenie się HOMO dienu na LUMO dienofila. Jest to możliwe, ponieważ oba orbitale mają odpowiednią symetrię, dzięki której mogą nakładać się w tej samej fazie.
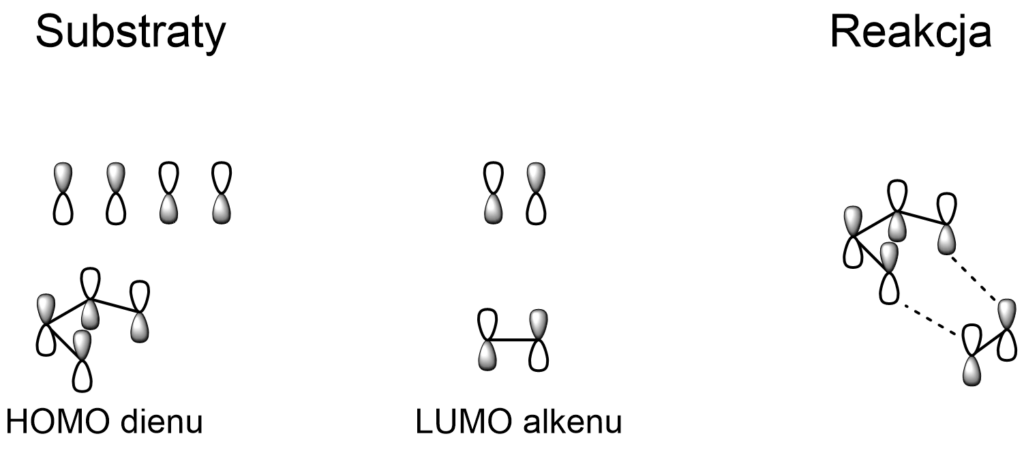
Choć wiemy już, że orbitale mają odpowiednią symetrię, by się nałożyć, pozostaje jeszcze jeden problem – różnica w ich poziomach energetycznych. Aby reakcja mogła zajść, energia HOMO dienu nie powinna znacznie różnić się od energii LUMO dienofila. Z tego powodu, reakcja między buta-1,3-dienem i etenem nie zachodzi szczególnie łatwo.
W klasycznej wersji reakcji Dielsa-Aldera, ten problem został rozwiązany przez użycie bogatego w elektrony dienu (grupy elektronodonorowe zwiększają energię HOMO) oraz ubogiego w elektrony dienofila, w którym wiązanie podwójne, najczęściej, jest sprzężone z grupą elektronoakceptorową.
Istnieje też inny wariant reakcji DA – Inverse Electron Demand DA, w której używany jest ubogi w elektrony dien i bogaty w elektrony dienofil.
Substraty do reakcji Dielsa-Aldera
Dien
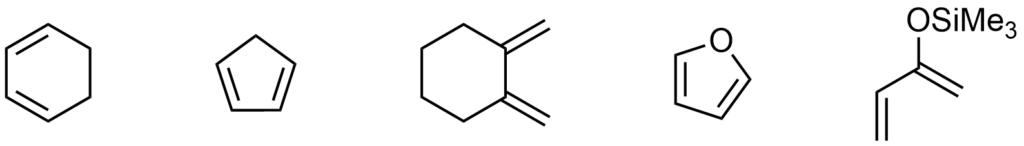
Prawie każdy dien może zostać użyty do reakcji DA, jedyny warunek, który musi spełniać, to być w stanie przyjąć konformację s-cis. Dzięki temu wiele cyklicznych dienów świetnie nadaje się do użycia.
Przykładowe dieny:
Dienofil
Za dienofile mogą służyć alkeny, których wiązanie podwójne jest sprzężone z grupą wyciągającą elektrony. Przykładowe dienofile:
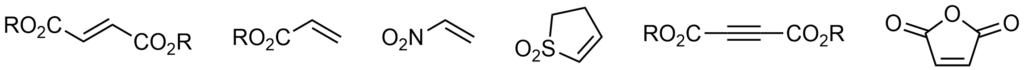
Regioselektywność w reakcji Dielsa-Aldera
O ile w przypadku reakcji z symetrycznie podstawionymi dienami i dienofilami, nie ma większych problemów z określeniem produktu, tak przy użyciu niesymetrycznych dienów i dienofili szukanie głównego produktu może przyprawić o zawrót głowy. Na szczęście, jest to możliwe, zwłaszcza, gdy spojrzymy na poszczególne struktury rezonansowe, a samą reakcją potraktujemy tak, jakby zachodziła według polarnego mechanizmu.
Przykład 1:
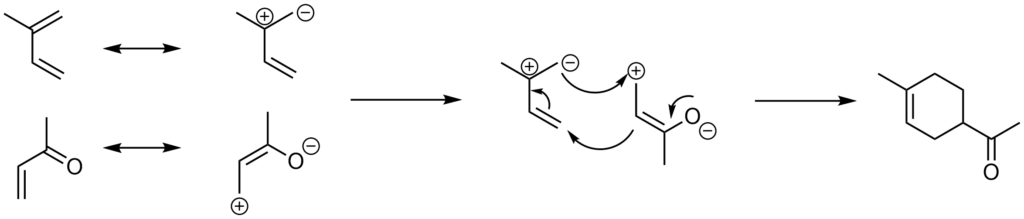
Przykład 2:
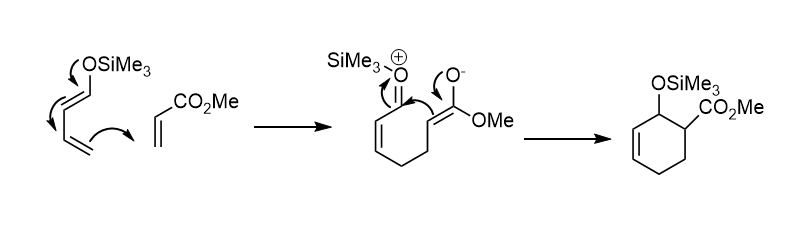
Na podstawie tych przykładów widać pewną zależność. Gdy w dienie obecna jest grupa elektronodonorowa, to kieruje podstawnik elektronoakceptorowy w pozycję 2 lub 4, względem siebie.
Podsumowując, wygląda to w ten sposób:
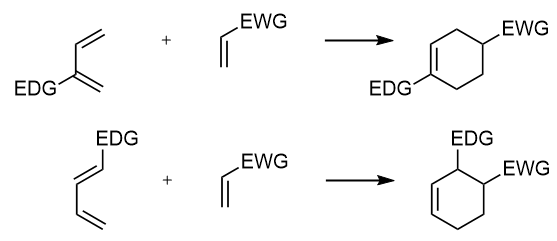
EDG: grupa elektronodonorowa; EWG: grupa elektronoakceptorowa
Warunki reakcji
Reakcja Dielsa-Aldera jest przykładem termicznej reakcji perycyklicznej, zatem zachodzi w podwyższonej temperaturze. Reakcja może być katalizowana kwasami Lewisa, jest to szczególnie częste w asymetrycznych wersjach tej cykloaddycji.
Stereochemia
W reakcji powstaje mieszanina dwóch diastereoizomerów – endo i egzo; pytanie brzmi, jak je rozpoznać?
Odpowiedzi na to pytanie dostarcza poniższy schemat:
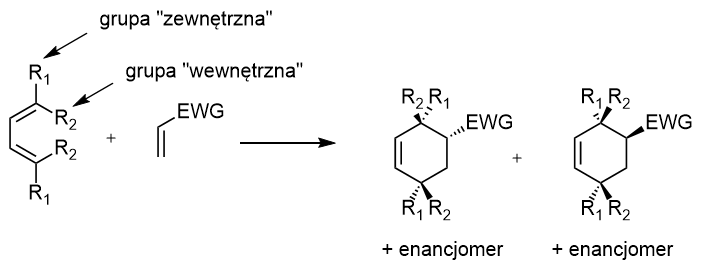
Gdy grupa „zewnętrzna” jest położona po tej samej stronie pierścienia, co grupa EWG, mamy do czynienia izomerem endo. W przeciwnym razie, jest to produkt egzo.
Kiedy otrzymujemy produkty endo i egzo?
Co do głównego produktu reakcji, najczęściej będziemy otrzymywać izomer endo (w przypadkach, gdy naszym substratem nie będzie związek aromatyczny). Wówczas, dominującym oddziaływaniem, które powoduje powstanie izomeru endo jest interakcja między wiązaniami π grupy elektronoakceptorowej i dienu. Warto wspomnieć, że izomer endo jest prodktem kinetycznym.

Produkt Endo może powstawać, gdy cykloaddycja jest odwracalna i w układ zaczyna ustalać się równowaga. W takich przypadkach, w większości, powstaje trwalszy termodynamicznie produkt endo. Można do tego doprowadzić używając m. in. furanu jako dienu.
Podsumowanie
To co należy zapamiętać:
– w reakcji Dielsa-Aldera, reaguje dien i dienofi, a produktem jest związek o pierścieniu sześcioczłonowym,
– aby reakcja zaszła HOMO dienu i LUMO dienofila muszą być zbliżone poziomami energetycznymi, przez co do dienów dodaje się grupy elektronowodonorowe, a do dienofila elektronowoakceptorowe,
– produkty reakcji niesymetrycznych substratów są 1,2 lub 1,4 podstawione (gdy na każdym substratów jest tylko jeden dodatkowy podstawnik),
– najczęściej diastereoizomerem powstającym w przewadze jest izomer endo.
Zadania
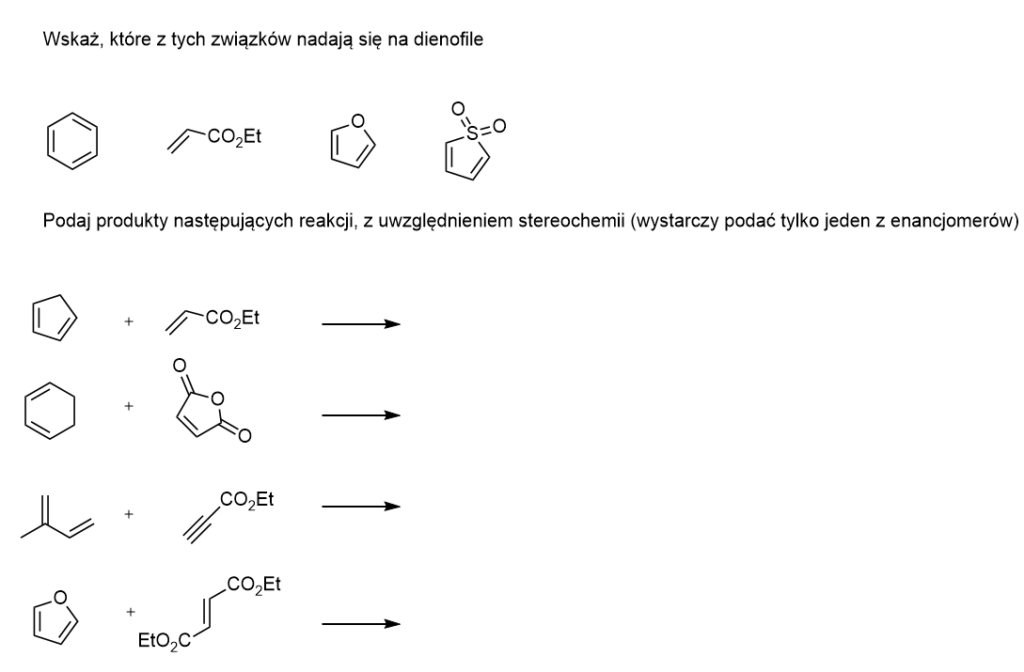
Literatura
- Clayden, Jonathan, Nick Greeves, and Stuart Warren. 2012. Organic Chemistry. 2nd ed. London, England: Oxford University Press;
- McMurry, John. 2016. 9th ed. Warszawa, Polska: PWN;
- https://www.masterorganicchemistry.com/2018/02/09/endo-exo-diels-alder-telling-them-apart/