Synteza o różanym zapachu – rozwiązanie
Zgodnie z obietnicą prezentujemy rozwiązanie do ostatniego zadania z syntezy. Mamy nadzieję, że nie okazało się ono zbyt trudne.
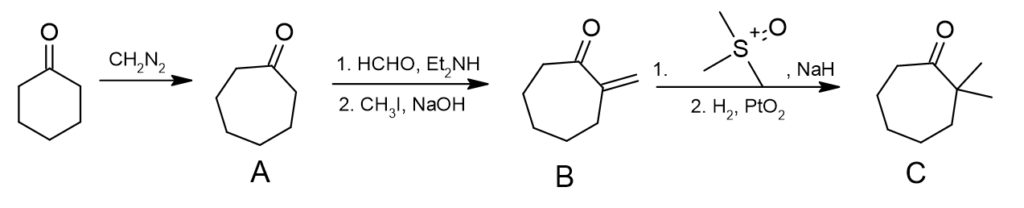
a) Struktury cząsteczek A–C
– cykloheksanon ulega reakcji z diazometanem, w której następuje przegrupowanie z udziałem karbenu, prodwadzące do zwiększenia pierścienia,
– A → B, na tym etapie zachodzą dwa przekształcenia – reakcja Mannicha (1) oraz eliminacja czwartorzędowej aminy (2),
– związek C powstaje przez uwodornienie cyklopropanu (2), powstającego w wyniku reakcji ylidu sulfoksoniowego ze sprzężonym wiązaniem podwójnym (1). Co ciekawe, ta reakcja została przedstawiona w części B tegorocznego folderu wstępnego.
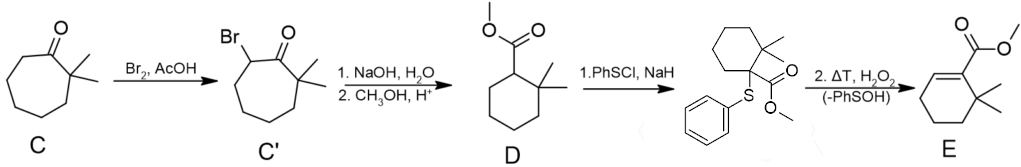
Wzory cząsteczek C’–E
– związek C’ powstaje przez jednokrotne bromowanie związku C,
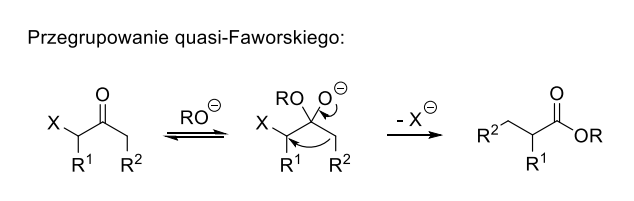
– przekształcenie C’ → D to przykład reakcji quasi-Favorskiego (1), która zostanie dokładniej omówiona w dalszej części wpisu, zakończone estryfikacją (2),
– związek E powstaje w sekwencji trzech reakcji: fenylosulfidowania, utlenienia i elimnacji kwasu sulfenowego. W tym miejscu chciałbym przeprosić za pomyłkę w wyniku której na schemacie w zadaniu jest pokazana eliminacja PhSO2H zamiast PhSOH.
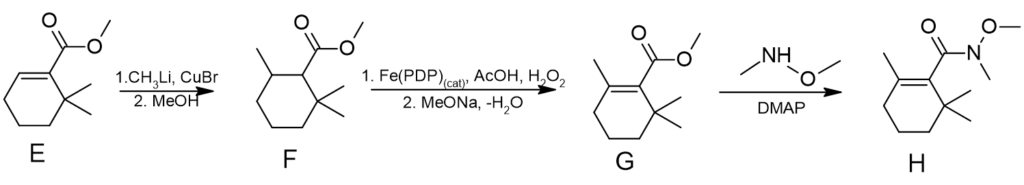
Wzory cząsteczek F – H
– związek E ulega addycji 1,4 do wiązania sprzężonego z grupą karbonylową, do czego niezbędna jest kataliza solą miedzi(I). Reakcję kończy dodanie metanolu,
– w przekształceniu F → G zostały użyte dwie reakcje (1) utlenienie White-Chen’a, które selektywnie utlenia jeden z atomów węgla oraz (2) eliminacja powstałego alkoholu, która prowadzi do nienasyconego estru,
– związek H to przykład amidu Weinreba. Jego dalsza reakcja ze związkiem litoorganicznym (związek Grinarda też może zostać użyty) prowadzi do utworzenia ketonu, będącego produktem końcowym.
b) Związek C’ ulega reakcji quasi-Favorskiego, która prowadzi do utworzenia kwasu karboksylowego i w tym przypadku, do zmniejszenia pierścienia. Ta reakcja pojawiła się na finale 69 Ogólnopolskiej Olimpiady Chemicznej, gdzie także opisano jej mechanizm:
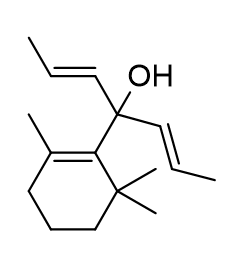
c) W reakcji związku G najprawdopodbniej głównym produktem będzie trzeciorzędowy alkohol. Reakcja z pierwszą cząsteczką to przykład substytucji acylowej, w wyniku której powstaje keton, bardziej elektrofilowy od substratu. Doprowadzi to do reakcji z kolejną cząsteczką nukleofila. Zastosowanie amidu Weinreba powoduje utworzenie się trwałego stanu pośredniego, po addycji pierwszej cząsteczki związku litoorganicznego, który rozpada się pod wpływem wodnych roztworów kwasów, z utworzeniem ketonu. Produkt reakcji związku G:
Bibliografia
1. Clayden, J., Greeves, N., & Warren, S. (2012). Organic Chemistry (2nd ed.). Oxford University Press,
2. https://www.olchem.edu.pl/kategoria_zadan/olimpiady-krajowe,
3. https://www.organic-chemistry.org/namedreactions/weinreb-ketone-synthesis.shtm
4. Aliphatic C–H Oxidations for Late-Stage Functionalization,
M. Christina White and Jinpeng Zhao Journal of the American Chemical Society 2018 140 (43), 13988-14009DOI: 10.1021/jacs.8b05195
5. Unusual Cyclopropanation of 9-Bromocamphor Derivatives: A Novel Formal C(1)−C(7) Bond Cleavage of Camphor,
Wei-Dong Z. Li and Yu-Rong YangOrganic Letters 2005 7 (14), 3107-3110DOI: 10.1021/ol051141e