Analiza mieszaniny soli
Cześć, dziś przychodzę z raczej prostym zadaniem z chemii nieorganicznej. Mam nadzieję, okaże się pomocne w przygotowaniach do Olimpiady. Zapraszam.
Analiza mieszaniny soli
Laboratorium chemiczne dostało za zadanie analizę jakościową i ilościową wilgotnej próbki mieszaniny dwóch soli: A i B. O solach tych laborant wiedział wstępnie, że B pochodzi od anionu kwasu tlenowego a A od kwasu beztlenowego. Aby dowiedzieć się o składzie mieszaniny wykonał następujące badania.
Na wadze analitycznej odważył 4,504g badanej mieszaniny i rozpuścił ją w 100mL wody destylowanej w zlewce szklanej. Zaobserwował, że odważka rozpuściła się w całości i powstała mieszanina jednorodna w fazie ciekłej. Do owej mieszaniny dodawał roztwór wodny chlorku wapnia aż do całkowitego wytrącenia się osadu z roztworu. W toku badań laborant stwierdził, że jest to fazowo czysta sól C która wykrystalizowała pod postacią monohydratu. Otrzymane ciało stałe poddał analizie termograwimetrycznej odsączając biały osad na sączku. Początkowo sól ta ważyła 3,248g. Podczas ogrzewania tej soli w tyglu stwierdził, że zaobserwował 3 ubytki masy: pierwszy w temperaturze 120°C, drugi w temperaturze powyżej 350°C i ostatni w temperaturze powyżej 650°C. Gazy, które się wydzieliły podczas ogrzewania zebrał i zmierzył ich objętość. Pod ciśnieniem 101,3kPa i w temperaturze pokojowej (293K) zajmowały one objętość 1,604dm3. Dane te pozwoliły mu uzyskać informację o anionie soli B.
Roztwór, który pozostał po strącaniu soli C wykorzystał, aby zbadać pozostały skład mieszaniny. W tym celu dodano do niego roztworu wodnego AgNO3 (w nadmiarze) strącając biały osad soli D, który ważył około 2,304g. Laborant dodając do niego wodnego roztworu amoniaku o stężeniu 17% (m/m) dowiedział się, że osad ten się w nim całkowicie rozpuścił. Całkowite rozpuszczenie tej soli zaszło po dodaniu 2,64cm3 wodnego roztworu amoniaku.
Dokonując analizy kationu w soli A postanowił tym razem sporządzić nową próbkę analityczną rozpuszczając około 1g mieszaniny w 50mL wody destylowanej i zamaskowując pozostałe jony w roztworze tak aby skupić się tylko na kationie A. Próba płomieniowa wykazała, że roztwór ten barwi płomień palnika gazowego na kolor fioletowy. W toku dalszych badań dowiedział się również, że kationy w solach A i B są izomorficzne z tym, że ten w soli B zawiera 5 razy więcej atomów niż ten w soli A.
Polecenia:
a. Zidentyfikuj jony wchodzące w skład soli B oraz podaj wzór cząsteczkowy tej soli. Odpowiedź poprzyj odpowiednimi obliczeniami.
b. Podaj wzór cząsteczkowy soli C i napisz reakcję otrzymywania tej soli w sposób cząsteczkowy.
c. Napisz równania reakcji zachodzących podczas ogrzewania soli C. Przyporządkuj temperaturę rozkładu odpowiedniej reakcji.
d. Podaj wzór cząsteczkowy soli D. Odpowiedź poprzyj odpowiednimi obliczeniami. Napisz równanie reakcji rozpuszczania tej soli w roztworze wodnym amoniaku w sposób cząsteczkowy.
e. Podaj wzór cząsteczkowy soli A.
f. Wyprowadź wzór na zawartość procentową tlenu w mieszaninie soli. Oblicz tą zawartość.
Wyniki pośrednie przybliżać do 4 miejsca znaczącego.
Gęstość roztworu amoniaku [17%(m/m)] wynosi 0,9328g/cm3. Stała gazowa R=8,314J/(molK)
Odpowiednie masy molowe zaczerpnij ze swojego układu okresowego.
Wskazówka: Wyniki pośrednie postaraj się zaokrąglać do czwartego miejsca znaczącego.
Analiza mieszaniny soli – odpowiedzi do zadania
- 3-krotny rozkład soli C podczas jej prażenia może wnosić o tym że mamy do czynienia z anionem szczawianowym C2O4 2- . Najpierw zaszłoby usunięcie wody z cząsteczki monohydratu, potem rozkład szczawianu z wydzieleniem CO i węglanu i finalnie rozkład węglanu do CO2 i CaO. Można to poprzeć obliczeniami pisząc odpowiednie reakcje rozkładu:
(1) CaC2O4 · H2O = CaC2O4 + H2O↑
(2) CaC2O4 = CaCO3 + CO↑
(3) CaCO3 = CaO + CO2↑
Dobrze tutaj widać, że ilość wydzielonych gazów jest 3 razy większa od początkowej ilości (moli) hydratu. Wiedząc to możemy policzyć ilość moli hydratu (h) korzystając w równania stanu gazu doskonałego:
nh = 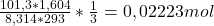
Mh = 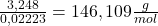
Co zgadza się z masą molową CaC2O4 · H2O czyli B to (NH4)2C2O4 i w skład tej soli wchodzą aniony szczawianowe i kationy amonowe. O kationie amonowym mogliśmy się dowiedzieć z końcowej treści zadania (podpunkt e).
b. Sól C już wydedukowaliśmy na drodze soli B. Sól C to monohydrat szczawianu wapnia [wzór cząsteczkowy: CaC2O4 · H2O]. Reakcja otrzymywania:
(NH4)2C2O4 + CaCl2 + H2O = CaC2O4 · H2O + 2NH4Cl
c. Reakcje rozkładu termicznego ustaliliśmy w pierwszym podpunkcie, możemy teraz ustalić w jakich temperaturach zachodzą te przemiany.
CaC2O4 · H2O = CaC2O4 + H2O↑ około 120°C
CaC2O4 = CaCO3 + CO↑ powyżej 350°C
CaCO3 = CaO + CO2↑ powyżej 650°C
d. Sól D powstała na skutek strącania strącania nieznanego anionu z kationem srebra(I). Z początkowej treści zadania wnioskujemy, że może być to anion fluorowca (X) dlatego, że anion soli A pochodzi od anionu kwasu beztlenowego. Aby poznać symbol X musimy policzyć ile moli amoniaku potrzeba, aby rozpuścić 2,304g soli. Liczymy stężenie molowe amoniaku i jego ilość moli:
c= 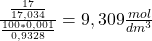
n= 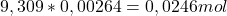
Z równania reakcji soli D z amoniakiem wiemy, że potrzebna jest 2 razy większa ilość (moli) amoniaku niż soli aby reakcja zaszła:
AgX + 2NH3 = [Ag(NH3)2]X
Czyli nAgX= 0,0123mol i MAgX= 2,304/0,0123 = 187,32g/mol co pokrywa się z masą molową AgBr. Dochodzimy tym samym do odpowiedzi:
AgBr + 2NH3 = [Ag(NH3)2]Br Sól D: AgBr
e. Z poprzedniego podpunktu wiemy, że anionem w soli A jest anion bromkowy. O kationie dowiadujemy się z informacji dostarczonej przez analizę płomieniową: to kation K+ daje charakterystyczną barwę płomienia palnika gazowego:

A: KBr
Kation potasu jest izomorficzny z kationem amonowym, oznacza to że w sieci krystalicznej oba jony zajmują bardzo podobne objętości w komórce elementarnej w krysztale jonowym. Powoduje to, że oba jony zachowują się w sposób bardzo podobny pod względem chemicznym.
f. Możemy zacząć od policzenia ilości szczawianu amonu w próbce o masie 4,504g.
Już wiemy ze jego ilość moli była 0,02223 (tyle samo co hydratu soli wapnia) czyli wystarczy, że wymnożymy tą ilość przez jego masę molową i uzyskujemy m(NH4)2C2O4=2,76g. Analogicznie z KBr, wiemy, że:
nAgBr=nBr-=nKBr=0,0123mol, mKBr=1,46g
Wyglada na to, że suma mas soli nie jest równa całkowitej masie naważki. Oznacza to, że reszta tej masy przypada na masę wody – na początku treści zadania jest informacja o tym, że próbka dostarczona do laboratorium do analizy jest wilgotna. Więc masa wody:
mH2O=4,504-1,46-2,76=0,284g; stąd ułamki masowe:
m(KBr)= 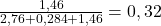
m(H2O)=0,063
m(szczawian amonu)= 1-0,063-0,32=0,617
f. Procent tlenu w mieszaninie można wyrazić następującym wzorem:
Σ%Om
Oznacza to, że suma iloczynów (ułamek masowy składnika mieszaniny · zawartość masowa tlenu w tym składniku) daje zawartość procentową tlenu w mieszaninie. W naszym przypadku:
51,6% · 0,617 + 0% · 0,32 + 88,81% · 0,063 = 37,4%
Mam nadzieję, że zadanie nie sprawiło Wam większych kłopotów. W razie pytań dot. zadania to można je zadać w komentarzu i spróbuję na nie odpowiedzieć.