Antybiotyk z grzyba – rozwiązanie
Rozwiązanie najtrudniejszego (póki co) zadanka na naszym blogu, wraz z pełnym rozumowaniem i dodatkowymi, fajnymi reakcjami.
W zadaniu pojawiły się trzy trudne reakcje (prowadzące do powstania związków B, F i G) – każda z nich została opatrzona dodatkową podpowiedzią. Właśnie tak należy podchodzić do tego na olimpiadzie – jeśli dostajemy bonusową informację, zapewne odpowiedź nie jest oczywista.
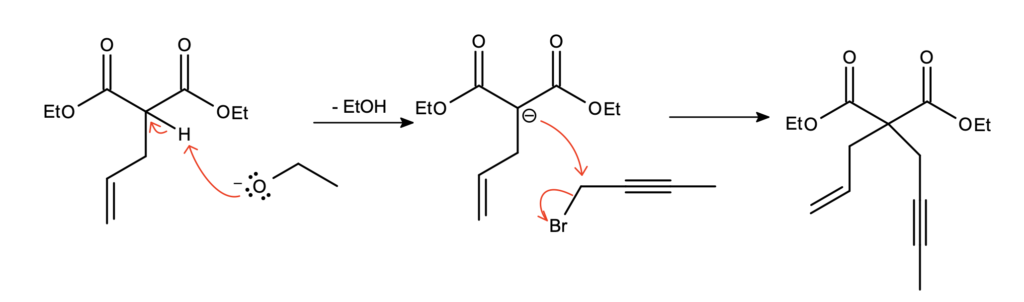
Koszmarnie trudne zadanie zaczynamy od banalnie prostej reakcji – nie ma wątpliwości, że jest to klasyczne alkilowanie enolanu malonianu odpowiednim halogenkiem. Stechiometria też jest oczywista – substrat zawiera tylko jeden wodór 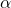 , dlatego nastąpi tylko jednokrotne alkilowanie:
, dlatego nastąpi tylko jednokrotne alkilowanie:
Następnie „zaczyna się zabawa” – widzimy dziwny katalizator, dwa różne tlenki węgla pod chorymi ciśnieniami, a związek, z którego wychodzimy, nie wydaje nam się kojarzyć z żadną śmieszną reakcją. Olimpiada nie polega na szczęście na wkuwaniu tysięcy reakcji na pamięć, tylko na domyślaniu się zachodzących procesów na podstawie minimum informacji. Tak jest też tutaj – dysponujemy dwoma potężnymi wskazówkami, informacjami o różnicy mas molowych oraz o formalnym mechanizmie. Zacznijmy od analizy pierwszej z nich.
Bardzo dobrym strzałem będzie uznanie, że zmiana masy molowej odpowiada addycji tlenku węgla(II) – nie należy tego nadmiernie komplikować. Pytanie, co tlenek węgla zrobi – nie ma zbyt wielu reakcji, w których standardowo bierze on udział. Dostajemy tu ratującą podpowiedź o uproszczonym mechanizmie.
Oznaczenie [2+2+1] oznacza, że w reakcji biorą udział:
- Część
 , składająca się z 2 atomów
, składająca się z 2 atomów - Część
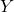 , składająca się z innych 2 atomów
, składająca się z innych 2 atomów - Część
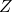 , składająca się z jednego atomu
, składająca się z jednego atomu
Części 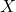 i
i 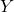 to prawdopodobnie wiązanie podwójne oraz potrójne – w cykloaddycjach mamy w końcu do czynienia z ich zrywaniem lub tworzeniem. A czym jest tajemniczy element jednoatomowy?
to prawdopodobnie wiązanie podwójne oraz potrójne – w cykloaddycjach mamy w końcu do czynienia z ich zrywaniem lub tworzeniem. A czym jest tajemniczy element jednoatomowy?
Najczęściej jest to atom z wolną parą elektronową, który może również przyjąć elektrony. Są to więc np. wszystkie karbeny oraz azot, tlenek siarki(IV) czy tlenek węgla(II). Reakcje pericykliczne, w których takie cząsteczki biorą udział, tworząc dwa wiązania do jednego ze swoich atomów, nazywane są chelotropowymi. Poniżej kilka przykładów:
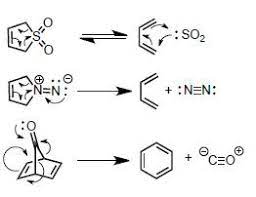
Wobec tego jasne jest, jak tlenek węgla(II) dwa zareaguje:
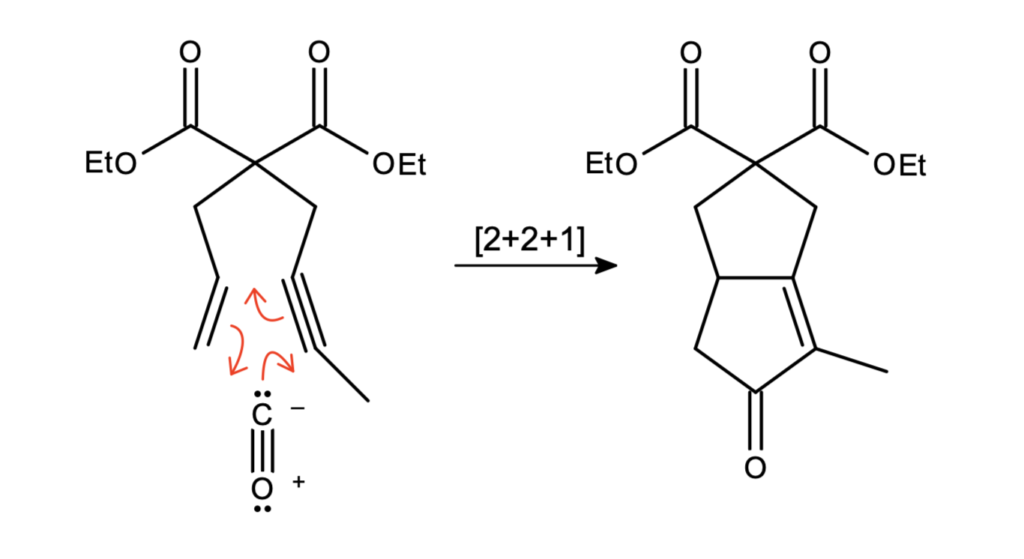
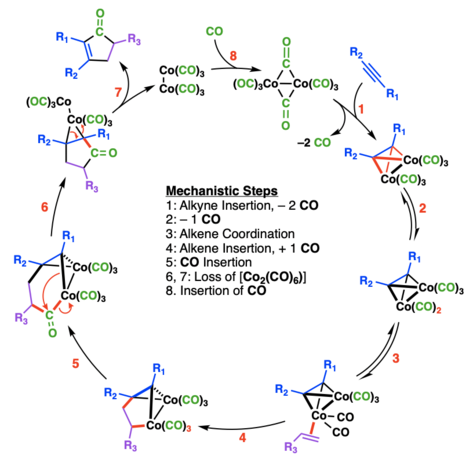
W rzeczywistości mechanizm ten jest dużo bardziej złożony, przebiega przez aż 8 etapów, poniżej jego schemat. Zainteresowanych zachęcam do przyjrzenia się reakcji Pausona-Khanda i jej stereochemii.
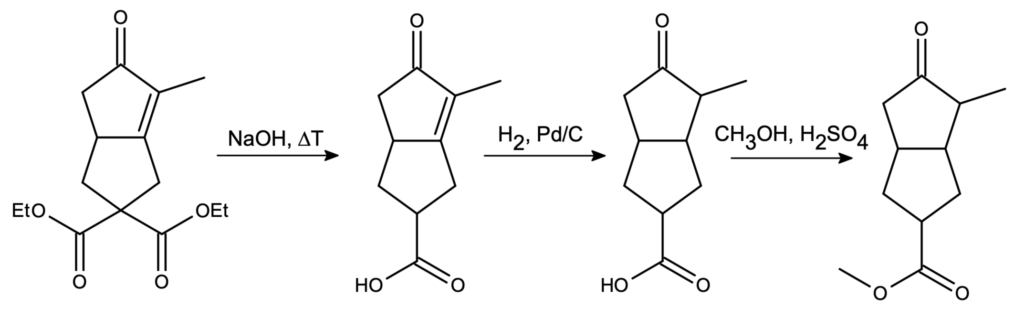
Następnie mamy trzy bardzo łatwe, następujące po sobie reakcje. Są to:
- Hydroliza estrów etylowych z dekarboksylacją (podwyższona temperatura);
- Redukcja wiązania podwójnego węgiel-węgiel;
- Estryfikacja metanolem.
Pora na zaporową i najtrudniejszą reakcję w całym zadaniu – jeśli udało Ci się przez nią przejść, lub był*ś blisko, gratulacje! 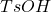 to kwas p-toluenosulfonowy, o mocy zbliżonej do kwasu siarkowego. Zanim zaczniemy rozważania, można od razu odrzucić możliwość zajścia transestryfikacji z alkoholem – nie ma wtedy jak zajść przegrupowanie Claisena.
to kwas p-toluenosulfonowy, o mocy zbliżonej do kwasu siarkowego. Zanim zaczniemy rozważania, można od razu odrzucić możliwość zajścia transestryfikacji z alkoholem – nie ma wtedy jak zajść przegrupowanie Claisena.
Bardzo trudno wpaść na pomysł, co robić dalej. W takich momentach można spróbować rozumowania „od tyłu”. Aby zaszło przegrupowanie Claisena, MUSI pojawić się eter allilowo-winylowy. W związku E nie ma choćby jednego wiązania podwójnego 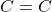 , oba będą musiały więc powstać.
, oba będą musiały więc powstać.
Można również przeanalizować wzór sumaryczny produktu – po „dodaniu” wzoru sumarycznego związku E oraz wzoru sumarycznego użytego alkoholu widać, że produkt zawiera o jeden atom tlenu oraz dwa atomy wodoru mniej – odpowiada to ubytkowi cząsteczki wody. Mamy już jakiś punkt zaczepienia.
Gdy rozważamy, skąd może pochodzić ta cząsteczka wody, jako najbardziej prawdopodobna opcja narzuca się ubytek protonowanej grupy hydroksylowej z alkoholu allilowego po ataku przez atom tlenu; powstałby wtedy eter allilowy. Do otrzymania eteru allilowo-winylowego wystarczy już tylko oderwanie wodoru alfa z utworzeniem eteru enolu i może zajść upragnione przegrupowanie:
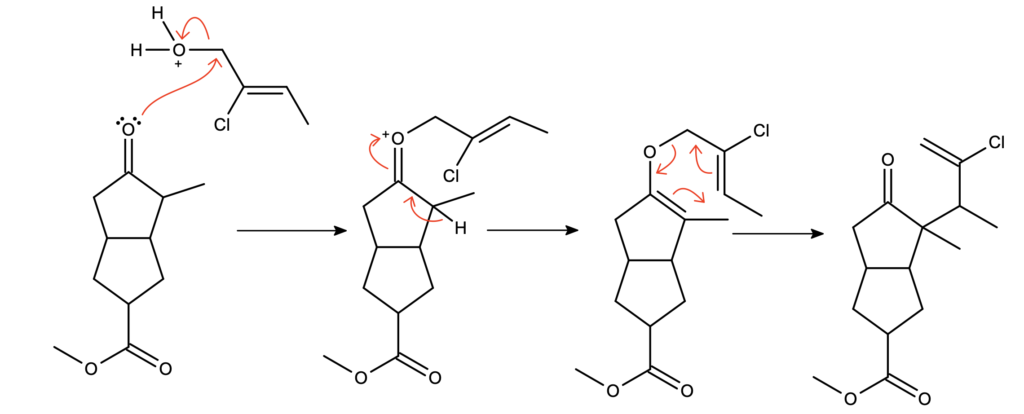
Kolejną reakcją, zachodzącą pod wpływem stężonego kwasu siarkowego, nie jest hydroliza estru, jak mogłoby się na pierwszy rzut oka wydawać – wtedy mielibyśmy 2 grupy karbonylowe, a wskazówka mówi nam o 3 różnych grupach karbonylowych. Jedyną inną grupą funkcyjną, zdolną do wygenerowania grupy karbonylowej, jest alken z atomem chloru. Start od addycji protonu do wiązania podwójnego jest dobrym pomysłem – powstaje drugorzędowy karbokation, stabilizowany dodatkowo przez rezonans z atomem chloru. Następnie widzimy addycję wody, jak w uwadnianiu alkenów. Należy sobie w tym momencie uświadomić, że geminalne (takie, że oba podstawniki znajdują się przy tym samym atomie) halohydryny są nietrwałe – natychmiastowo dochodzi do utworzenia grupy karbonylowej przez eliminację halogenu. Tak otrzymujemy keton:
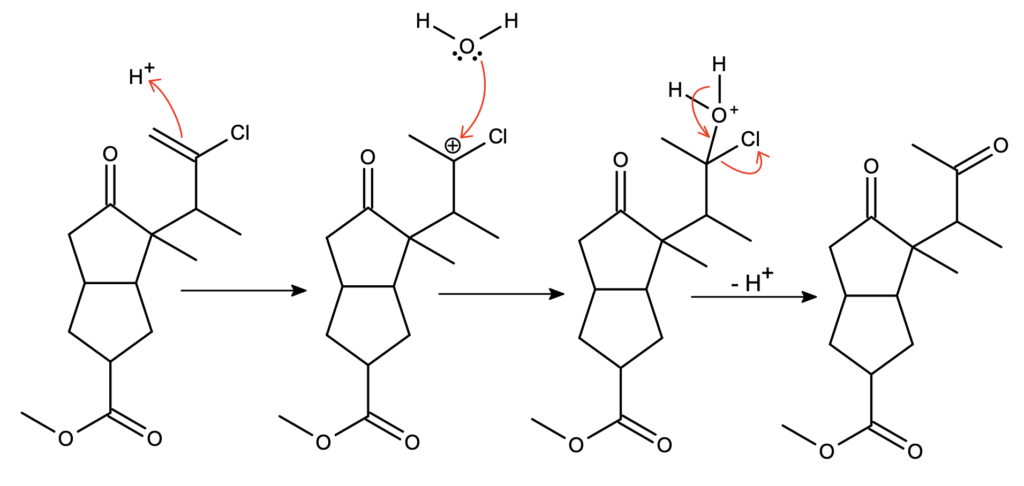
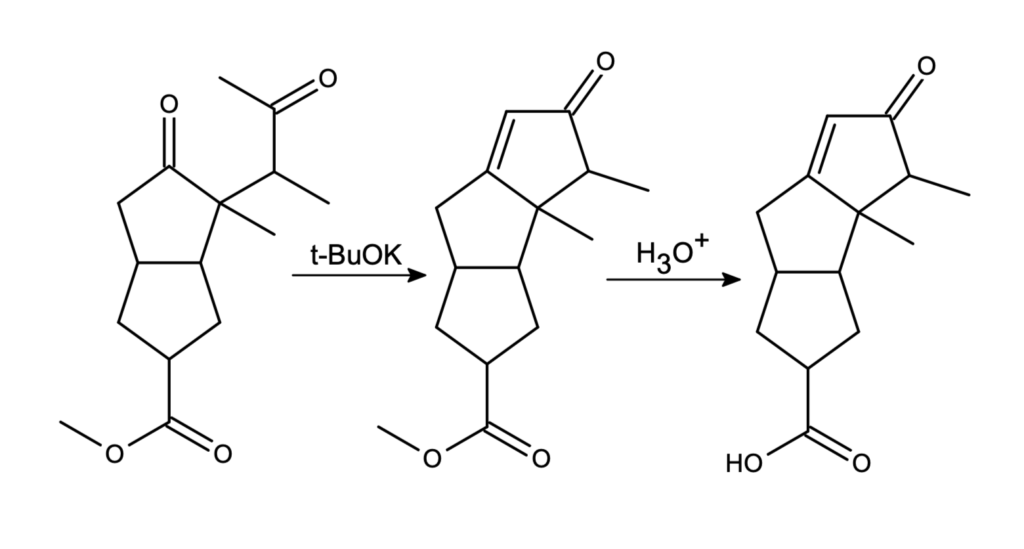
To była już ostatnia trudna reakcja. Następnie mamy wewnątrzcząsteczkową kondensację aldolową, w wyniku której otrzymujemy tricykliczny związek H, będący estrem. Antybiotyk, zgodnie z treścią, jest kwasem, powstającym poprzez kwasową hydrolizę związku H:
Na koniec krótkie pytanie o różnicę w powinowactwie siarki i tlenu do antybiotyku. Sprzężona addycja to motyw znany z addycji Michaela. Siarka jest lepszym nukleofilem, gdyż jej wolne pary elektronowe znajdują się na bardziej oddalonych od jądra orbitalach – są więc słabiej przyciągane. Bardziej zaawansowani zawodnicy mogą wytłumaczyć to również przy pomocy teorii HSAB.
Mam nadzieję, że zadanko Cię nie wystraszyło i choć odrobinę się spodobało. 🙂 Czekam na ewentualne zażalenia/przemyślenia/pochwały w komentarzach.
Komentarze |0|
Tagi: III etap, Koszmarnie trudne zadanko, Leki, Metaloorganika, Naturalny związek, Przegrupowanie, Reakcje pericykliczne, Synteza