Nietypowe aminokwasy – rozwiązanie
Kwestia trudności tego zadania jest kontrowersyjna (reszta redakcji uważa, że pasowałoby na II etap), jako autor pozostanę jednak przy etykietce „I etap na wyrost”.
Poniżej rozwiązanie zadania krok po kroku wraz z proponowanym tokiem rozumowania.
a) (3 m.) Narysuj wzór strukturalny związku X
Wydzielający się, trujący gaz o zapachu migdałów można od razu zidentyfikować jako 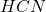 – oznacza to, że związek X jest nitrylem (zawiera grupę
– oznacza to, że związek X jest nitrylem (zawiera grupę 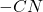 ). Dodatkowo, na podstawie informacji o dwóch różnych reakcjach z odczynnikiem Grignarda, można podejrzewać obecność dwóch różnych grup funkcyjnych reagujących z odczynnikiem Grignarda, np. grupy karbonylowej bądź sprzężonego wiązania podwójnego. Wskazówka o masie molowej poniżej
). Dodatkowo, na podstawie informacji o dwóch różnych reakcjach z odczynnikiem Grignarda, można podejrzewać obecność dwóch różnych grup funkcyjnych reagujących z odczynnikiem Grignarda, np. grupy karbonylowej bądź sprzężonego wiązania podwójnego. Wskazówka o masie molowej poniżej 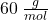 mocno ogranicza nam ilość możliwych wzorów, poniżej kilka pomysłów:
mocno ogranicza nam ilość możliwych wzorów, poniżej kilka pomysłów:
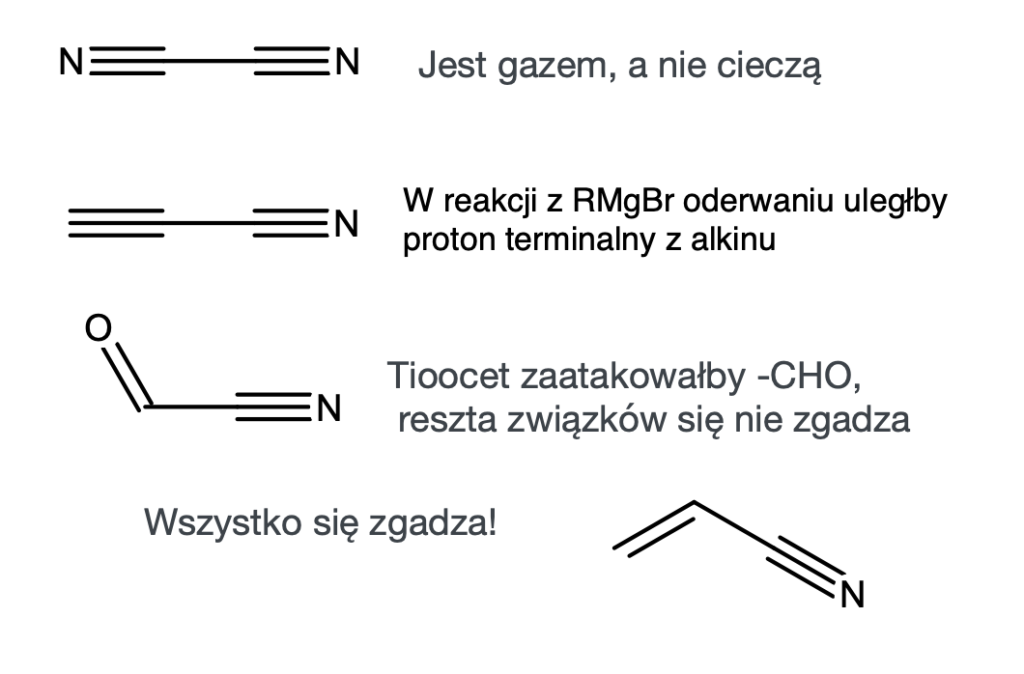
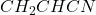 ).
).b) (3 m.) Przedstaw produkty dwóch opisanych reakcji X z dowolnym odczynnikiem Grignarda
Grupa nitrylowa zachowuje się w wielu aspektach podobnie do grupy karbonylowej – z samym odczynnikiem Grignarda będzie więc zachodzić bezpośrednia addycja do grupy nitrylowej (jak atak na ketony). W obecności katalitycznej ilości jonów miedzi(I) zachodzi natomiast najpierw transmetalowanie, podczas którego powstaje analog odczynnika Gilmana (który powinien kojarzyć Ci się przede wszystkim ze sprzężoną addycją do  -nienasyconych związków karbonylowych), a następnie sprzężona addycja do wiązania podwójnego:
-nienasyconych związków karbonylowych), a następnie sprzężona addycja do wiązania podwójnego:
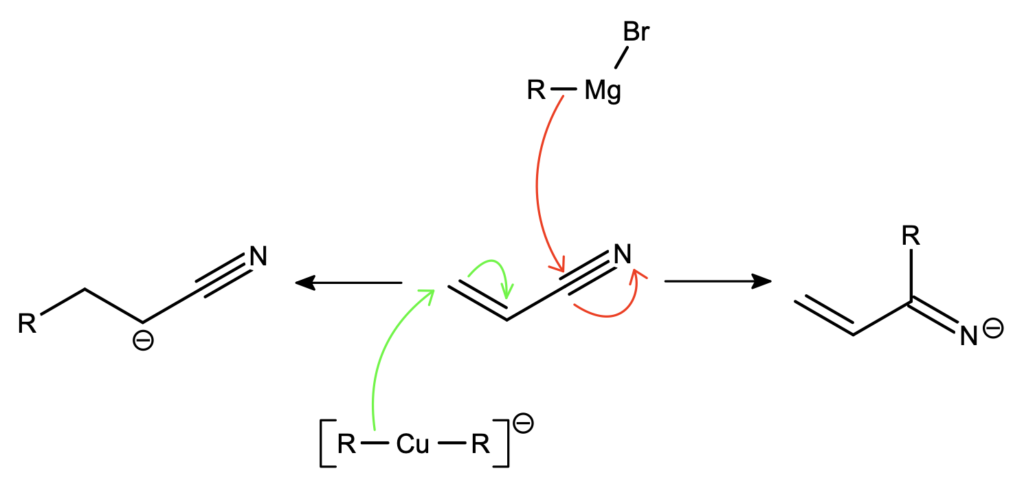
Ambitniejszych czytelników zachęcam bardzo do zapoznania się z teorią HSAB, tłumaczącą m.in. tę różnicę w reaktywności związków metaloorganicznych.
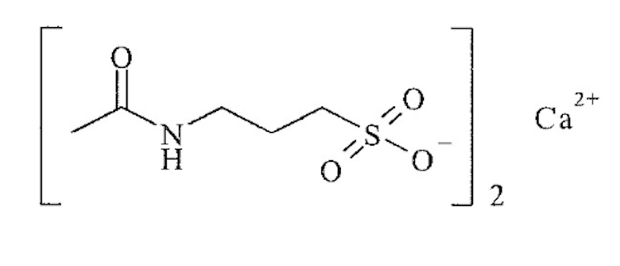
c) (8 m.) Narysuj wzory strukturalne związków A, B, Y i Akamprozatu.
Pierwsza reakcja jest zdecydowanie najtrudniejsza – potem już będzie z górki. Poprzednie polecenie miało nakierować rozwiązującego na możliwość zajścia addycji sprzężonej. Właśnie taka addycja zachodzi – siarka jako miękki nukleofil preferuje tę reakcję od ataku na grupę 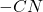 . Intuicja podpowiada również, że po teoretycznej, bezpośredniej addycji, reszta reakcji/związków nie trzyma się kupy. Wytworzenie sobie takiej czujności jest niezwykle pomocne w czasie zawodów i mówi nam, kiedy trzeba się cofnąć i coś poprawić.
. Intuicja podpowiada również, że po teoretycznej, bezpośredniej addycji, reszta reakcji/związków nie trzyma się kupy. Wytworzenie sobie takiej czujności jest niezwykle pomocne w czasie zawodów i mówi nam, kiedy trzeba się cofnąć i coś poprawić.
Reakcja z 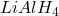 jest już prostsza – po uświadomieniu sobie, że dziwny związek z siarką jest analogiem estru (po hydrolizie otrzymalibyśmy kwas karboksylowy i tiol), widać, że jest to po prostu usunięcie ze związku grupy acetylowej. Manewr został tak przeprowadzony, gdyż użyty w pierwszej reakcji ciekły kwas tiooctowy jest o wiele dogodniejszym reagentem od gazowego i trującego siarkowodoru. Nie należy też zapomnieć o nitrylu, grupa
jest już prostsza – po uświadomieniu sobie, że dziwny związek z siarką jest analogiem estru (po hydrolizie otrzymalibyśmy kwas karboksylowy i tiol), widać, że jest to po prostu usunięcie ze związku grupy acetylowej. Manewr został tak przeprowadzony, gdyż użyty w pierwszej reakcji ciekły kwas tiooctowy jest o wiele dogodniejszym reagentem od gazowego i trującego siarkowodoru. Nie należy też zapomnieć o nitrylu, grupa 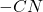 jest redukowana przez tetrahydroglinian do
jest redukowana przez tetrahydroglinian do 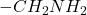 .
.
Nadtlenek wodoru zazwyczaj jest utleniaczem i tak też jest tym razem. Pozostaje wątpliwość: do czego utleni się atom siarki – siarki(IV) czy (VI)? Tu ratuje nas informacja o właściwościach kwasowo-zasadowych Y; by były one zbliżone do tauryny, związek ten również musi zawierać grupę 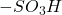 .
.
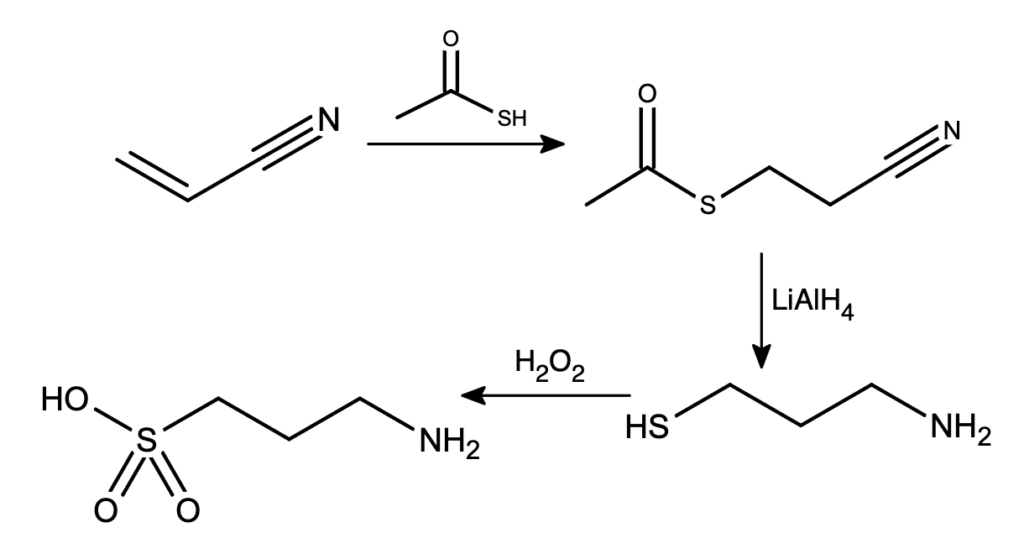
Teraz pora na Akamprozat (oczywiście chodzi o poznanie jego struktury) – możemy założyć, że w jednym molu Akamprozatu jest jeden mol kationów wapnia. Skąd to śmiałe założenie? Primo – jeśli mielibyśmy ich więcej, masa molowa leku musiałaby być przerażająco duża (na 2 atomy wapnia, byłoby to ponad 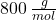 ), a takich rzeczy po pierwszym etapie się zazwyczaj nie spodziewamy. Secundo – cząsteczka Y, w zależności od stanu protonacyjnego, może mieć ładunek co najwyżej -1. Przewidujemy więc początkowo, że akamprozat to
), a takich rzeczy po pierwszym etapie się zazwyczaj nie spodziewamy. Secundo – cząsteczka Y, w zależności od stanu protonacyjnego, może mieć ładunek co najwyżej -1. Przewidujemy więc początkowo, że akamprozat to 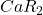 (gdzie
(gdzie 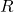 oznacza resztę kwasową związku Y). Sprawdźmy co z tego wyjdzie, obliczając masę molową kandydata na szukany związek:
oznacza resztę kwasową związku Y). Sprawdźmy co z tego wyjdzie, obliczając masę molową kandydata na szukany związek:
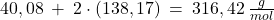
A teraz obliczmy masę molową szukanego związku z założeniem, że jest tylko jeden jon wapnia, dzieląc masę molową wapnia przez jego zawartość procentową:
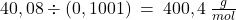
Coś się nie zgadza i to bardzo, różnica prawie 84 g/mol jest poważna. W takim momencie zawodnik ma trzy opcje:
- Stwierdza, że Olchem nie jest dla niego i planuje wyjazd na zbieranie truskawek do Holandii;
- Olewa to zadanie i próbuje „odbić się” na innych zadaniach;
- Kombinuje dalej i walczy!
Weźmy najbardziej optymistyczną opcję. Dobrym spostrzeżeniem może być, że bezwodnika octowego nie dodano raczej dla zabawy i marnotrawstwa, coś musi robić. Typowo służy do zabezpieczania *czegoś* grupą acetylową (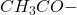 ). Jaką zmianę w masie molowej powoduje takie zabezpieczenie? Dodajemy grupę acetylową o masie molowej
). Jaką zmianę w masie molowej powoduje takie zabezpieczenie? Dodajemy grupę acetylową o masie molowej 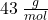 , a „zabieramy” atom wodoru o masie molowej
, a „zabieramy” atom wodoru o masie molowej 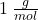 . Daje to przyrost o
. Daje to przyrost o 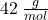 . I nagle różnica w wynikach
. I nagle różnica w wynikach 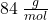 przestaje wydawać się już czymś złym, a nawet nas cieszy – to w końcu dwie grupy acetylowe! Założenia nie były złe, tylko trzeba było się im przyjrzeć. Oczywiście jedyną grupą zdolną do przyłączenia acetylu jest grupa aminowa.
przestaje wydawać się już czymś złym, a nawet nas cieszy – to w końcu dwie grupy acetylowe! Założenia nie były złe, tylko trzeba było się im przyjrzeć. Oczywiście jedyną grupą zdolną do przyłączenia acetylu jest grupa aminowa.
d) (10 m.) Narysuj wzory strukturalne związków C, D, E i F.
Otrzymywanie związku C to prosta reakcja maturalna – tworzenie 5 członowego laktonu. Potem zaczynają się schodki – widzimy cztery różne reagenty w jednym przejściu, w tym fosfor czerwony, który nie jest powszechnie znanym odczynnikiem. W takich sytuacjach można się zdać na swoje wybitnie dobre myślenie mechanistyczne bądź na podstawie załączonych wskazówek, zgadywać strukturę produktu. Czasem połączenie obu tych dróg jest dobrym pomysłem.
Brak reakcji z 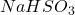 oznacza brak wolnej grupy
oznacza brak wolnej grupy 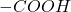 , można podejrzewać, że produkt jest estrem metylowym, skoro dodano metanol – atak metanolu na lakton prowadziłby do otwarcia się pierścienia. Po co jednak wcześniej brom i fosfor? Jest to zamaskowana forma innego, już bardziej znanego reagenta –
, można podejrzewać, że produkt jest estrem metylowym, skoro dodano metanol – atak metanolu na lakton prowadziłby do otwarcia się pierścienia. Po co jednak wcześniej brom i fosfor? Jest to zamaskowana forma innego, już bardziej znanego reagenta – 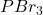 ; może on powstać przez reakcję bromu z fosforem. Do szczęścia potrzebujesz wiedzieć o nim dwie rzeczy – przeprowadza alkohole w bromki (spróbuj narysować mechanizm!) oraz bierze udział w reakcji Hella-Volharda-Zelinskiego. Reakcja ta pozwala na wprowadzenie bromu do pozycji alfa w kwasie, co jest dogodną metodą syntezy aminokwasów. W zadaniu mamy do czynienia z osobliwym przypadkiem obu tych reakcji naraz! Produktem jest
; może on powstać przez reakcję bromu z fosforem. Do szczęścia potrzebujesz wiedzieć o nim dwie rzeczy – przeprowadza alkohole w bromki (spróbuj narysować mechanizm!) oraz bierze udział w reakcji Hella-Volharda-Zelinskiego. Reakcja ta pozwala na wprowadzenie bromu do pozycji alfa w kwasie, co jest dogodną metodą syntezy aminokwasów. W zadaniu mamy do czynienia z osobliwym przypadkiem obu tych reakcji naraz! Produktem jest 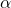 -bromoester, w którym alkoholowa grupa
-bromoester, w którym alkoholowa grupa 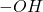 została dodatkowo zamieniona na
została dodatkowo zamieniona na 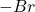 . Zgadza się to z zawartością procentową bromu w tym związku, która od początku wskazywała na jego dużą ilość.
. Zgadza się to z zawartością procentową bromu w tym związku, która od początku wskazywała na jego dużą ilość.
Reakcja z dziwną aminą nie jest już dziwna – dochodzi do substytucji obu atomów bromu z utworzeniem aminowego pierścienia czteroczłonowego. Czemu nie można było użyć po prostu amoniaku? Mogłyby powstać wtedy produkty uboczne pochodzące od zaatakowania kolejnej cząsteczki D z utworzeniem soli. Duże, powodujące zatłoczenie grupy fenylowe temu zapobiegają.
Na koniec kolejna dziwna reakcja, ale mamy dużo podpowiedzi! Po pierwsze – masa produktu poniżej 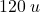 . Trudno by to zrealizować przy obecności dużych i ciężkich grup fenylowych, najpewniej coś więc „odpadnie”. W zidentyfikowaniu „odpadających” fragmentów pomaga nam informacja o zrywaniu nietrwałych wiązań
. Trudno by to zrealizować przy obecności dużych i ciężkich grup fenylowych, najpewniej coś więc „odpadnie”. W zidentyfikowaniu „odpadających” fragmentów pomaga nam informacja o zrywaniu nietrwałych wiązań 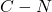 i
i 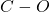 (zrywanie wiązań poprzez ich uwodornienie). Oderwie się więc difenylometan – od atomu azotu, a także metan – od atomu tlenu, ponieważ mowa o aminoKWASIE, więc związek F musi zawierać wolną grupę
(zrywanie wiązań poprzez ich uwodornienie). Oderwie się więc difenylometan – od atomu azotu, a także metan – od atomu tlenu, ponieważ mowa o aminoKWASIE, więc związek F musi zawierać wolną grupę 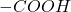 .
.
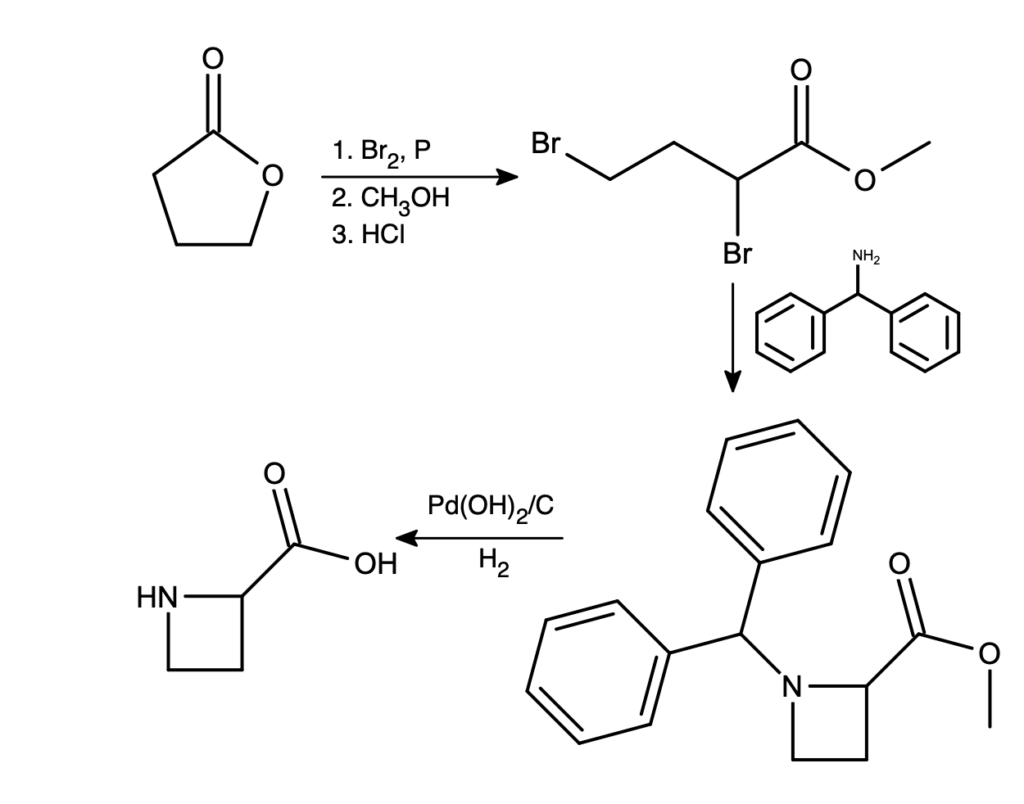
Bardziej zaznajomieni z biochemią od razu dostrzegą podobieństwo strukturalne otrzymanego aminokwasu do proliny – różnią się one jedynie rozmiarem pierścienia. Tłumaczy to jego toksyczne działanie.
Mam nadzieję, że zadanko się choć odrobinę podobało. Zachęcam do pochwalenia się swoim wynikiem w komentarzach.