Dać chemikowi kawałek metalu…
Zadanie z chemii analitycznej, z elementami „wiedzy ogólnej”. Poziom II etapu – może niezbyt trudne, ale dość pracochłonne. Wszystkie potrzebne dane znajdują się poniżej treści zadania.
Zadanie 1
Mosiądz – stop miedzi i cynku, często wzbogacany różnymi dodatkami – jest znany ludzkości od przynajmniej 2500 lat. Mniej podatny na korozję od czystej miedzi, w dzisiejszych czasach służy do wyrobu m.in. armatury, instrumentów muzycznych czy łusek amunicji.
Próbkę mosiądzu o masie 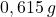 bardzo dokładnie rozdrobniono (sproszkowano) i wprowadzono do zimnego, rozcieńczonego roztworu
bardzo dokładnie rozdrobniono (sproszkowano) i wprowadzono do zimnego, rozcieńczonego roztworu 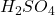 . Ustalono, że wydzielony podczas reakcji gaz, pod ciśnieniem
. Ustalono, że wydzielony podczas reakcji gaz, pod ciśnieniem 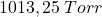 i w temperaturze
i w temperaturze 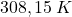 , zajmuje objętość około
, zajmuje objętość około 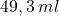 .
.
a) (2 m.) Oblicz procent masowy cynku w badanym mosiądzu z dokładnością do trzech cyfr znaczących, jeżeli wiadomo, że w skład stopu wchodzi jedynie miedź i cynk.
Wśród prostych ligandów nieorganicznych, wyjątkowo trwałe kompleksy z metalami przejściowymi tworzą tlenek węgla 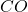 oraz izoelektronowe z nim jony nitrozylowy
oraz izoelektronowe z nim jony nitrozylowy 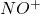 i cyjankowy
i cyjankowy 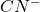 . Wynika to przede wszystkim z ich właściwości
. Wynika to przede wszystkim z ich właściwości 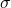 -donorowych i
-donorowych i 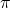 -akceptorowych (które omówione są w podręcznikach do chemii nieorganicznej). W praktyce laboratoryjnej największe znaczenie mają cyjanki, używane na przestrzeni wieków np. w górnictwie czy dezynfekcji, a w formie cyjankowych kompleksów metali – także w medycynie czy jako barwniki. Stałe trwałości kompleksów cyjankowych metali, choć zazwyczaj bardzo wysokie, potrafią różnić się dla porównywalnych kompleksów (tzn. o takiej samej geometrii lub przynajmniej liczbie koordynacyjnej) nawet o kilkanaście rzędów wielkości.
-akceptorowych (które omówione są w podręcznikach do chemii nieorganicznej). W praktyce laboratoryjnej największe znaczenie mają cyjanki, używane na przestrzeni wieków np. w górnictwie czy dezynfekcji, a w formie cyjankowych kompleksów metali – także w medycynie czy jako barwniki. Stałe trwałości kompleksów cyjankowych metali, choć zazwyczaj bardzo wysokie, potrafią różnić się dla porównywalnych kompleksów (tzn. o takiej samej geometrii lub przynajmniej liczbie koordynacyjnej) nawet o kilkanaście rzędów wielkości.
Największą „sławę” cyjanki zyskały jednak przez swoją silną toksyczność – mimo wyczuwalnego dla większości populacji zapachu gorzkich migdałów, cyjanek potasu wykorzystywany był jako skuteczna i wygodna trucizna. W trakcie konfliktów zbrojnych kapsułki z cyjankiem stanowiły środek umożliwiający szybkie popełnienie samobójstwa, pozwalającego uniknąć pochwycenia przez wroga. Podczas II wojny światowej, ponad milion ludzi zostało zamordowanych cyjanowodorem w komorach gazowych.
b) (7 m.) Oblicz 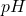 roztworu, powstałego przez rozpuszczenie w kieliszku (
roztworu, powstałego przez rozpuszczenie w kieliszku (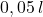 ) ampułki z
) ampułki z 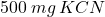 . Czy w takim
. Czy w takim 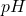 strąciłyby się nieapetyczne osady wodorotlenków, jeżeli woda ma poniższy skład mineralny? Załóż, że
strąciłyby się nieapetyczne osady wodorotlenków, jeżeli woda ma poniższy skład mineralny? Załóż, że 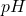 wody bez dodatku cyjanku wynosi
wody bez dodatku cyjanku wynosi 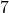 .
.
KATIONY (mg/l)
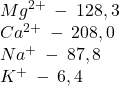
Próbkę stopu roztworzono w stężonym 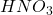 . Roztwór odparowano do białych dymów, aby pozbyć się nadmiaru kwasu; uzyskano w ten sposób próbkę A.
. Roztwór odparowano do białych dymów, aby pozbyć się nadmiaru kwasu; uzyskano w ten sposób próbkę A.
Pewien niezbyt błyskotliwy chemik postanowił przy pomocy cyjanków rozdzielić zawartą w próbce miedź od cynku – zamierzał uzyskać związek kompleksowy ![Rendered by QuickLaTeX.com Zn[Cu(CN)_{4}]_{2}](https://allchemicznie.com/wp-content/ql-cache/quicklatex.com-cea2e472f566e11a7b7236d65261a933_l3.png) . W tym celu do roztworu
. W tym celu do roztworu 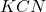 przeniósł taką ilość próbki A, że – według jego obliczeń – gdy cała się rozpuści, stężenie
przeniósł taką ilość próbki A, że – według jego obliczeń – gdy cała się rozpuści, stężenie ![Rendered by QuickLaTeX.com [Zn(CN)_{4}]^{2-}](https://allchemicznie.com/wp-content/ql-cache/quicklatex.com-13bc8ee19017b0adc3775ee6f42f69ae_l3.png) powinno być milion razy mniejsze od stężenia
powinno być milion razy mniejsze od stężenia 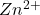 .
.
Zauważ, że jony 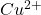 ulegają z cyjankami reakcji redox, wedle równania:
ulegają z cyjankami reakcji redox, wedle równania:
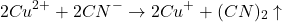
Powstająca miedź(I) jest natychmiast kompleksowana przez nadmiarowe jony cyjankowe.
W poniższych obliczeniach załóż, że miedź(II) została w całości zredukowana do miedzi(I), w żadnym momencie nie jest przekroczony iloczyn rozpuszczalności 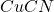 , a także że z roztworu usunięty został dicyjan
, a także że z roztworu usunięty został dicyjan 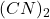 .
.
c) (2 m.) Wyraź 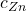 w zależności od
w zależności od 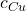 . Oblicz ten stosunek z dokładnością do trzech cyfr znaczących.
. Oblicz ten stosunek z dokładnością do trzech cyfr znaczących.
W poniższych obliczeniach załóż, że nie tworzą się kompleksy o liczbie koordynacyjnej innej niż 4.
d) (2 m.) Zapisz równanie, wyrażające stężenie analityczne cyjanków jako sumę stężeń wszystkich ich form.
e) (8 m.) Oblicz, ile może co najwyżej ważyć wyjściowa próbka stopu, jeżeli 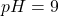 oraz jeżeli
oraz jeżeli 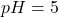 . Stężenie analityczne cyjanków w układzie, już po redukcji miedzi, wynosi
. Stężenie analityczne cyjanków w układzie, już po redukcji miedzi, wynosi 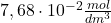 .
.
f) (2 m.) Jaki musi być ![Rendered by QuickLaTeX.com K_{So\:Zn_{3}[Cu(CN)_{4}]_{2}}](https://allchemicznie.com/wp-content/ql-cache/quicklatex.com-5ecbd91799057cd57dbb030c212a8bcb_l3.png) , aby obliczenia z punktu e) były poprawne? Czy w takim razie obliczone w punkcie e) wartości są prawdopodobne?
, aby obliczenia z punktu e) były poprawne? Czy w takim razie obliczone w punkcie e) wartości są prawdopodobne?
g) (1 m.) Zaproponuj praktyczniejszą (i mniej morderczą…) metodę rozdzielenia cynku i miedzi.
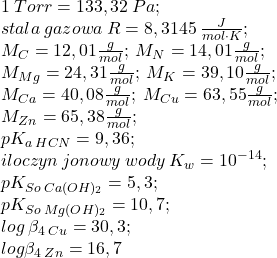
Komentarze |0|
Tagi: II etap, Iloczyn rozpuszczalności, Kompleksy, Metale, pH, Stała równowagi