Analiza pachnącego związku – rozwiązanie
Zadanie zaczyna olchemowa klasyka gatunku, czyli ozonoliza. Nie sposób zliczyć, ile razy się pojawiła, najczęściej właśnie w podobnym kontekście – otrzymujemy informację o małych „puzzlach” powstałych ze złożonego związku i musimy ułożyć z nich całość.
Struktury acetonu nie trzeba nikomu przedstawiać – na Olimpiadzie nie są wymagane nazwy rodzajowe złożonych związków, ale podstawy podstaw trzeba znać – w końcu to materiał na maturę. Przechodząc już do związku A – możemy wyznaczyć jego wzór empiryczny z procentów masowych. Aby to zrobić, najpierw dzielimy procent masowy danego pierwiastka przez jego masę molową. Pozwala nam to przejść z bezużytecznego stosunku masowego na fajniejszy stosunek atomowy. Ale zanim to, uwaga! ZAWSZE sprawdzaj, czy podane procenty sumują się do 100:
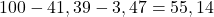
Jak widzisz, nie sumują się. Coś jeszcze odpowiada za pozostałe 55,14% masy. Najpewniej jest to tlen – w wyniku ozonolizy powstają w końcu związki z grupami karbonylowymi. Teraz można już przejść do właściwych obliczeń:
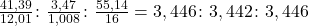
Widać bardzo ładnie, że stosunek atomowy 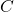 to 1:1:1, więc wzór empiryczny A to
to 1:1:1, więc wzór empiryczny A to 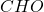 . Pojawia się tu problem – nie da się narysować żadnego stabilnego związku o tym wzorze – każdy z nich będzie rodnikiem (np. rodnikiem formylowym). Dzieje się tak, bo rzeczywisty wzór sumaryczny, ukazujący ILE mamy których atomów, może być (i często jest) wielokrotnością wzoru empirycznego, ukazującego tylko stosunek atomów do siebie. Świetnym tego przykładem jest glukoza o wzorze sumarycznym
. Pojawia się tu problem – nie da się narysować żadnego stabilnego związku o tym wzorze – każdy z nich będzie rodnikiem (np. rodnikiem formylowym). Dzieje się tak, bo rzeczywisty wzór sumaryczny, ukazujący ILE mamy których atomów, może być (i często jest) wielokrotnością wzoru empirycznego, ukazującego tylko stosunek atomów do siebie. Świetnym tego przykładem jest glukoza o wzorze sumarycznym 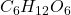 . Po skróceniu przez sześć otrzymujemy wzór empiryczny
. Po skróceniu przez sześć otrzymujemy wzór empiryczny 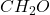 , wcale nieoddający jej rzeczywistej struktury. Nazwa „węglowodany” wzięła się właśnie stąd – początkowo o cukrach myślano jak o „hydratach węgla”. Wracając – wystarczy przemnożyć
, wcale nieoddający jej rzeczywistej struktury. Nazwa „węglowodany” wzięła się właśnie stąd – początkowo o cukrach myślano jak o „hydratach węgla”. Wracając – wystarczy przemnożyć 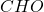 przez dowolną parzystą liczbę. Podejrzewamy, że będzie to prosty związek, najlepszym strzałem będzie więc
przez dowolną parzystą liczbę. Podejrzewamy, że będzie to prosty związek, najlepszym strzałem będzie więc 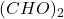 . Odpowiada to najprostszemu możliwemu dialdehydowi:
. Odpowiada to najprostszemu możliwemu dialdehydowi:
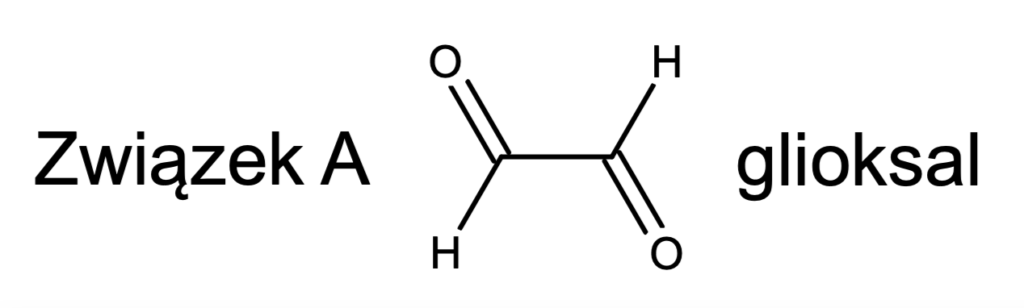
By poznać związek B, należy przeprowadzić reakcję „od tyłu” – pomyśl, co należy poddać kondensacji aldolowej, by otrzymać cyklopent-2-enon. Zawiera on pierścień, zaszła więc wewnątrzcząsteczkowa kondensacja – związek B zawiera dwie grupy karbonylowe. Dobrym podejściem jest „przecięcie” obecnego w produkcie wiązania podwójnego, by wyobrazić sobie substrat (przypomnij sobie mechanizm kondensacji aldolowej). Narysuj go „poglądowo”, a następnie przerysuj ładnie, tak, jak należałoby to zrobić w karcie odpowiedzi na olimpiadzie:
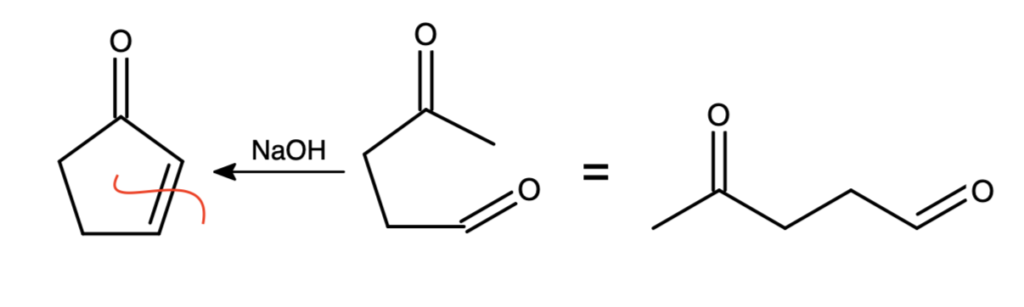
Super, mamy już wszystkie trzy fragmenty potrzebne do układanki. Teraz pytanie – jak je ułożyć? Dla przypomnienia, podczas klasycznej ozonolizy wiązanie podwójne „rozcinane” jest na dwie grupy karbonylowe. Należy więc próbować „łączyć” grupy karbonylowe z tych trzech cząsteczek, aby uzyskać propozycje struktur związku X. Po rozważeniu wszystkich możliwości, otrzymalibyśmy cztery różne struktury. Ale w tym zadaniu nie może być przecież kilku prawidłowych odpowiedzi! Musimy więc wykorzystać dodatkowe informacje o związku X. Wiemy, że „ulega reakcji z odczynnikiem Gilmana, dając związek zawierający czwartorzędowy atom węgla„. Odczynniki Gilmana to najważniejsze po odczynnikach Grignarda związki metaloorganiczne, jakie musisz znać na Olimpiadę – ich najpopularniejszą reakcją jest sprzężona addycja z 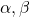 -nienasyconymi związkami karbonylowymi. Aby w wyniku reakcji z odczynnikiem Gilmana otrzymać związek z czwartorzędowym atomem węgla, substrat musi zawierać dipodstawiony atom węgla
-nienasyconymi związkami karbonylowymi. Aby w wyniku reakcji z odczynnikiem Gilmana otrzymać związek z czwartorzędowym atomem węgla, substrat musi zawierać dipodstawiony atom węgla 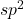 w pozycji beta do grupy karbonylowej:
w pozycji beta do grupy karbonylowej:

Jak się okazuje, ugrupowanie takie zawiera tylko jeden z czterech wcześniej proponowanych związków! Otrzymamy je tylko jeśli ketonową grupę karbonylową B „połączymy” z glioksalem, a aldehydową – z acetonem:
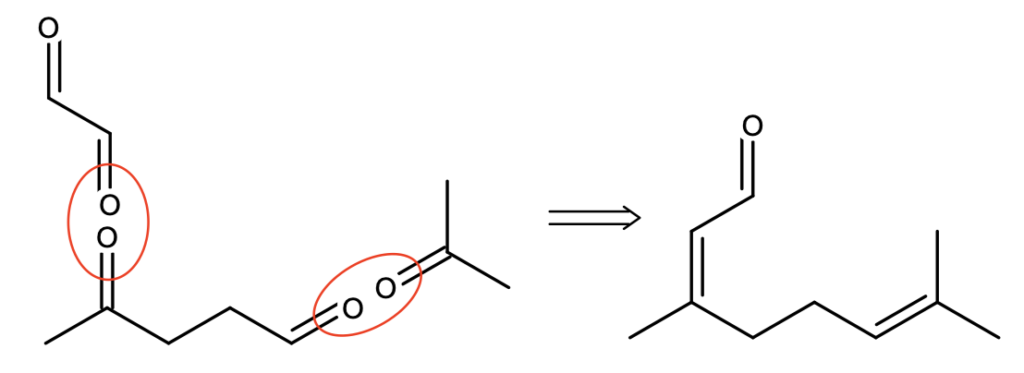
Reszta zadanka idzie już szybko: związek C po utlenieniu daje X, można go więc otrzymać przez redukcję grupy 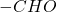 związku X do
związku X do 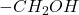 .
.
Związek D również jest alkoholem, nie wiemy jednak, do którego wiązania podwójnego limonenu nastąpiła addycja wody. Pomocą jest wskazówka o reakcji z 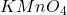 – następuje w niej utlenienie wiązania podwójnego. W przypadku, gdy utleniane jest wiązanie terminalne (obecna jest grupa
– następuje w niej utlenienie wiązania podwójnego. W przypadku, gdy utleniane jest wiązanie terminalne (obecna jest grupa 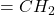 ), utlenia się ono „do maksimum”, uwalniając
), utlenia się ono „do maksimum”, uwalniając 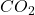 . Skoro dwutlenek węgla się nie wydziela, addycja wody musiała więc zajść właśnie do terminalnego wiązania podwójnego. Zgodnie z regułą Markownikowa, powstaje bardziej podstawiony, trzeciorzędowy alkohol:
. Skoro dwutlenek węgla się nie wydziela, addycja wody musiała więc zajść właśnie do terminalnego wiązania podwójnego. Zgodnie z regułą Markownikowa, powstaje bardziej podstawiony, trzeciorzędowy alkohol:
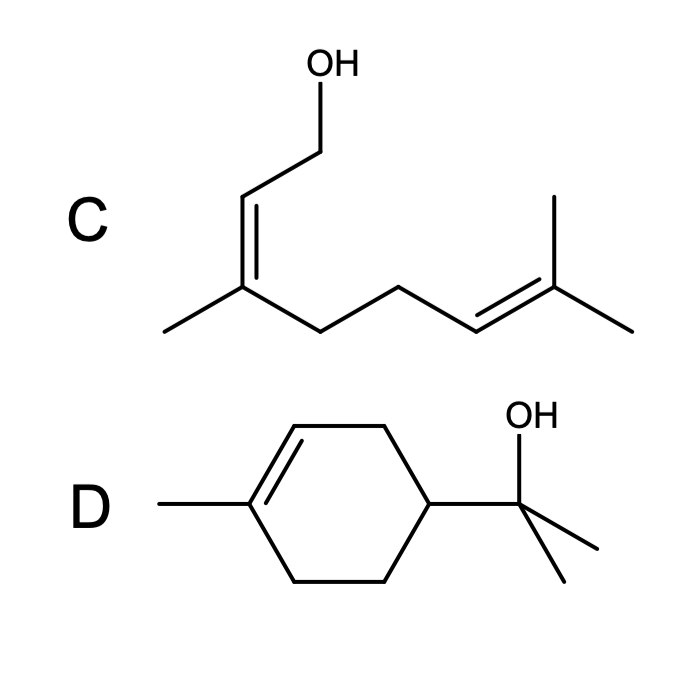
Pozostaje jeszcze kwestia mechanizmu zagadkowej reakcji – związki C i D są swoimi izomerami. Jest to trochę trudniejsze zagadnienie, raczej na poziomie II etapu – nie martw się, jeżeli nie udało Ci się rozwiązać tego podpunktu. Pod wpływem roztworu kwasu, związek C zmienia się w D. Jak napisano, pierwszym etapem tej cyklizacji jest protonowanie grupy 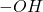 . Można podejrzewać, że dojdzie do oderwania się cząsteczki wody – powstanie stabilizowany rezonansem karbokation allilowy. Może on następnie zostać zaatakowany przez bogate w elektrony wiązanie podwójne, zamykając tym samym pierścień sześcioczłonowy i tworząc stabilny, trzeciorzędowy karbokation. Ostatnim etapem jest zaatakowanie karbokationu przez cząsteczkę wody i oderwanie protonu, czyli właściwie regeneracja katalizatora:
. Można podejrzewać, że dojdzie do oderwania się cząsteczki wody – powstanie stabilizowany rezonansem karbokation allilowy. Może on następnie zostać zaatakowany przez bogate w elektrony wiązanie podwójne, zamykając tym samym pierścień sześcioczłonowy i tworząc stabilny, trzeciorzędowy karbokation. Ostatnim etapem jest zaatakowanie karbokationu przez cząsteczkę wody i oderwanie protonu, czyli właściwie regeneracja katalizatora:
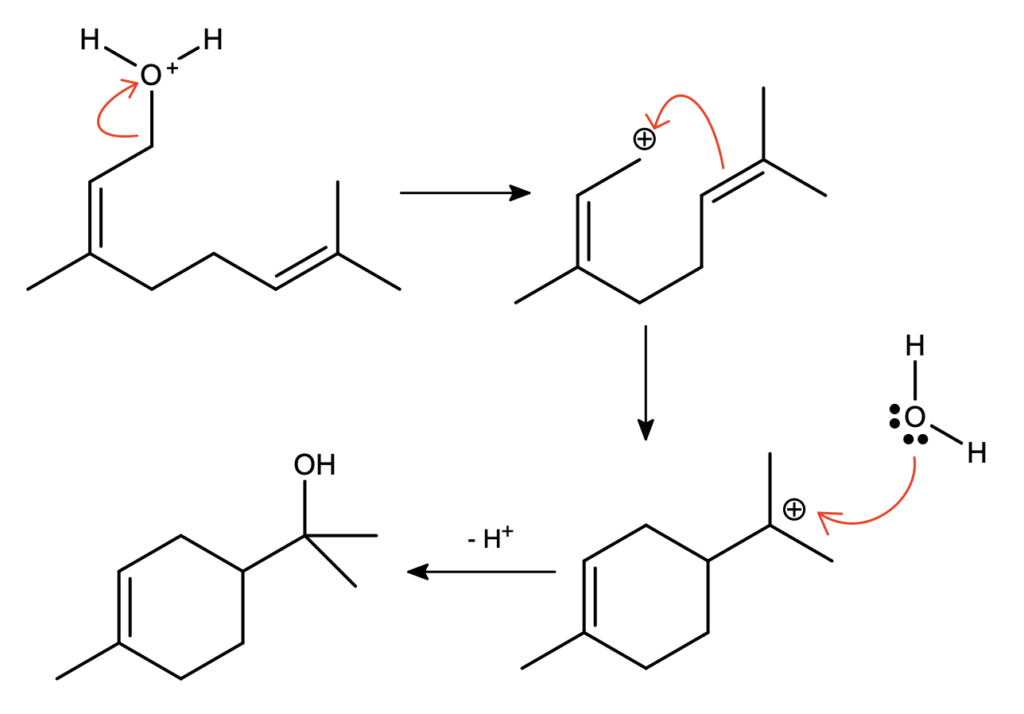
Gratuluję dobrnięcia do końca! Zadanko krótkie i przyjemne, ale sprawdzające wiedzę wymaganą na pierwszym etapie oraz umiejętność logicznego łączenia faktów.